酶动力学
作者: 医知苑
最后更新时间: 2024-01-09
作者: 医知苑
最后更新时间: 2024-01-09
酶是生物催化剂,其作用是提高反应速率,而本身不会耗尽或改变。它们特定于一种类型的反应和一种或少数密切相关的反应物(称为底物)。酶是细胞的重要组成部分,如果没有它们,许多生物反应就会太慢而无法维持生命。
酶动力学是对酶反应速率及其影响条件的研究。在本文中,我们将讨论酶的结构和功能、其临床意义和酶动力学理论。
酶的结构
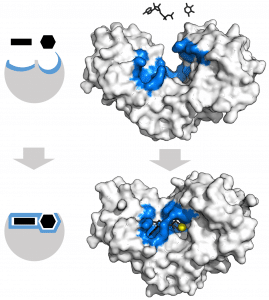
酶是蛋白质,通常具有球状三级结构。由于反应本身发生的活性位点的存在,它们的结构对其催化的反应以及所涉及的反应物具有高度特异性。这是酶内的一个小裂缝,具有特定的氨基酸结构,允许底物结合并形成酶-底物复合物(ES),该复合物通过弱键结合在一起,以便在反应完成时允许复合物解离。酶的其余部分充当支架,将这些关键氨基酸聚集在一起。
活性位点与其特定基底的形状互补。这种交互如何发生有两种主要模型:
- 锁和钥匙模型——活性位点与基质完美契合,无需任何改变即可结合。
- 诱导拟合模型——活性位点几乎与底物互补,但当它结合时,酶会发生构象变化,使其活性位点的形状更好地贴合。该理论比锁和钥匙模型更被普遍接受。
酶具有最佳发挥作用的最佳温度和 pH 值,具体取决于酶的功能以及细胞和器官的位置。pH 值的变化可以改变关键的电离状态,而温度的变化可以破坏重要的键,影响酶的结构,从而影响酶的功能。
如果暴露于温度和/或 pH 值的剧烈变化,活性位点的形状可能会改变。这称为酶变性,意味着酶将不再能够结合其底物或发挥其生物功能。
酶的功能
酶为反应提供了一种替代途径,其活化能(E a ) 较低,即发生反应并将底物转化为产物所需的最小能量输入。
过渡态是底物与其产物之间的分子中间体,反应通过它。例如,在下面的等式中,X 是过渡态。该过渡态具有比底物及其产物更高的自由能,然而,添加酶后过渡态得以稳定。
基材 → X → 产品
在弱底物结合时,酶的活性位点改变构象,使其比初始底物更适合过渡态,因此对该过渡态具有更高的亲和力。这减少了达到它所需的活化能。因此,当底物与活性位点结合时,会促使反应继续进行并转化为过渡态,最终形成反应的最终产物。这种能量有利的过程允许更多的底物分子在给定的时间内转化为产物。
由于过渡态能量较高,因此不稳定,只能短暂存在。它会自发转化为更稳定、能量更低的产物。该酶的活性位点对该产物的亲和力较低,因此会解离并释放。
限速步骤
任何反应的限速步骤都是最慢的步骤,这决定了整个反应的速度。在酶促反应中,酶-底物复合物向产物的转化通常是限速的。该步骤的速率(以及整个酶促反应)与酶-底物复合物的浓度成正比。
ES复合物的浓度随着反应的进行而变化,因此产物形成的速率也相应变化。当反应达到平衡(稳态阶段)时,ES 浓度(以及反应速率)保持相对恒定。
反应动力学
当将酶添加到底物中时,随后的反应分三个 阶段发生,具有不同的动力学:
| 阶段 | ES浓度 | 产物形成率 |
| 预稳态 | ES复合物快速爆发形成 | 最初很慢,等待ES形成,然后加速 |
| 稳态(平衡) | ES 浓度保持恒定,因为它的形成和分解速度一样快 | 形成速率恒定,比稳态前更快 |
| 后稳态 | 底物耗尽,因此形成的 ES 复合物更少 | 由于 ES 复合体较少,速度较慢;随着基质耗尽而减慢 |
预稳态阶段非常短,因为在微秒内达到平衡。因此,如果您测量反应最初几秒钟的速率,您将测量稳定状态下的反应速率。这是米氏动力学中使用的速率。
米氏动力学
米氏动力学是酶动力学的模型,它解释了酶催化反应的速率如何取决于酶及其底物的浓度。让我们考虑一个反应,其中底物 (S)可逆地与酶 (E) 结合,形成酶-底物复合物 (ES),然后发生不可逆反应,形成产物 (P) 并再次释放酶。
S + E ⇌ ES → P + E
米氏动力学中的两个重要术语是:
- Vmax – 当所有酶的活性位点都被底物饱和时,反应的最大速率。
- Km(也称为米氏常数)——反应速率为Vmax 50%时的底物浓度。Km 是酶对其底物的亲和力的量度,Km 值越低,酶在较低底物浓度下执行其功能的效率越高。
上述反应的 Michaelis-Menten 方程为:
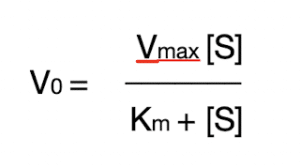
该方程描述了初始底物浓度 ([S]) 如何影响初始反应速率(V)。它假设反应处于稳定状态,其中 ES 浓度保持恒定。
当绘制底物浓度与反应速率的关系图时,我们可以看到随着底物浓度的增加,反应速率最初如何以线性方式快速增加(一阶动力学)。然后速率趋于稳定,增加底物浓度对反应速度没有影响,因为所有酶活性位点都已被底物饱和(0 级 动力学)。
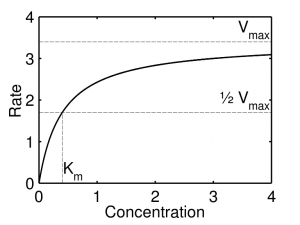
图 2 – 反应速率与底物浓度的关系图,展示了 Michaelis-Menten 动力学,其中突出显示了 Vmax 和 Km。
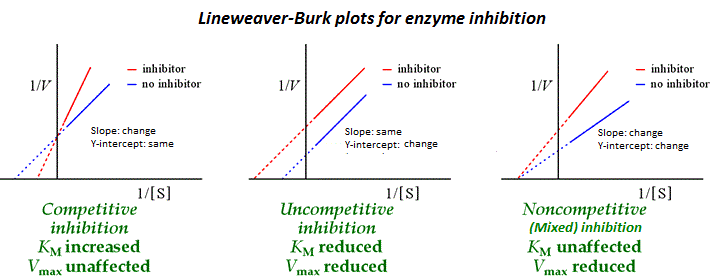
该反应速率相对于底物浓度的图具有矩形双曲线的形状。然而,米氏动力学的更有用的表示是称为Lineweaver-Burk 图的图,它绘制了反应速率的倒数 (1/r) 与底物浓度的倒数 (1/[S]) 的关系。
这会产生一条直线,可以更轻松地解释图表中的各种数量和值。例如,图表的 y 截距相当于 Vmax。当通过比较酶抑制对 Km 和 Vmax 的影响来确定酶抑制的类型时,Lineweaver-Burk 图也很有用。
临床相关性 -血浆酶测定
血浆酶测定可以检测血液中酶的异常水平。该测定测量样品中的活性单位,因此仅测量功能性酶。
- 如果某种酶的水平异常升高,则可能表明该酶通常存在于受损的组织中。
- 如果水平异常低,则可能表明该酶没有功能,产生速度比平时慢,或者分解速度很快,可能是由于遗传异常。
| 酶 | 地点 | 水平升高的原因 | 低水平的原因 |
| 乳酸脱氢酶 |
处处体现
具体同工酶:
|
急/慢性组织损伤,例如心肌梗塞
海拔高度可以表明损坏的程度 同工酶可能有助于定位损伤部位 |
|
| 天冬氨酸转氨酶(AST) | 分布广泛,但主要存在于肝脏、心脏、骨骼肌、肾脏、大脑和红细胞中 |
肝细胞损伤(急/慢性肝病)、胆囊疾病、肾功能衰竭、横纹肌溶解、心肌梗死
海拔高度可以表明损坏的程度 |
怀孕、糖尿病、脚气病(维生素 B1 缺乏) |
| 丙氨酸转氨酶(ALT) | 分布广泛,但主要分布在肝脏 |
肝细胞损伤(急性/慢性肝病)、胆管问题
比 AST 更特异的肝损伤标志物 |
|
|
碱性磷酸酶 (ALP) |
前列腺中浓度最高
在肝脏、骨骼、肾脏、肠道和胎盘中也发现了特定的同工酶 |
前列腺癌、胆道梗阻、高骨转换(生理性或病理性) |
|
| 肌酸激酶 |
在各种组织中表达
具体同工酶:
|
MM-- 骨骼肌营养不良
MB – 最近 2-3 天内心肌梗塞 BB-- 脑肿瘤 |
|
| 淀粉酶 | 胰腺外分泌、唾液 | 胰腺炎、感染、DKA、溃疡穿孔、肾功能衰竭 |
|
| 脂肪酶 | 外分泌胰腺 | 胰腺炎(比淀粉酶更具体) |
|
| 酸性磷酸酶 |
广泛表达
肝脏、红细胞、血小板和骨中的特定同工酶 |
前列腺癌的诊断和治疗 |
|
|
|
|
|
|